1. Khái niệm
Liên kết Van der Waals là một liên kết yếu giữa các phân tử, có bản chất tĩnh điện, được đảm bảo bởi lực hút giữa các lưỡng cực hoặc lưỡng cực cảm ứng.
Lực này giảm rất nhanh theo khoảng cách: F (1)
Liên kết Van der Waals thường được gọi là lực hút Van der Waals. Lực liên kết Van der Waals ở các hợp chất hữu cơ gồm 3 loại: lực tương tác lưỡng cực - lưỡng cực; lực tương tác lưỡng cực - lưỡng cực cảm ứng và lực tương tác lưỡng cực cảm ứng - lưỡng cực cảm ứng.
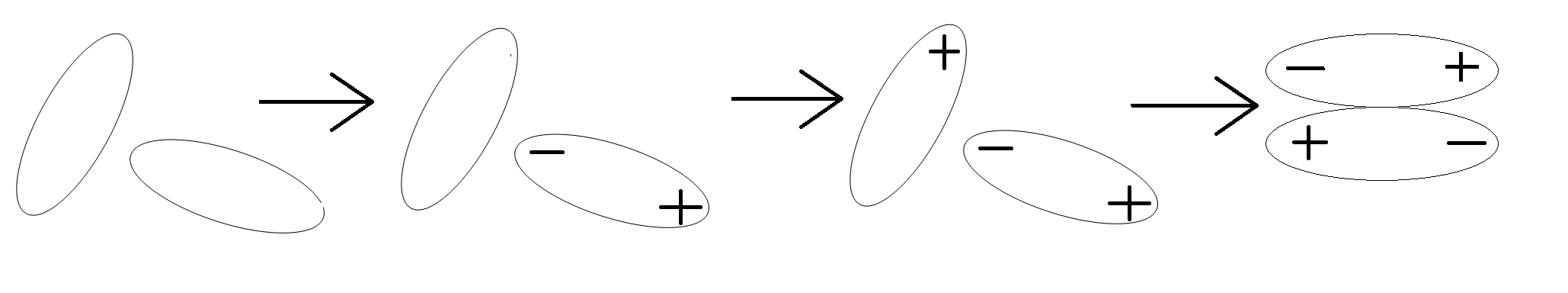
Lực tương tác Van der Waals
2. Phân loại
a. Lực tương tác lưỡng cực - lưỡng cực
Phân tử hợp chất hữu cơ có cấu tạo từ nguyên tử của các nguyên tố có độ âm điện khác nhau, vì thế trong phân tử luôn có những liên kết phân cực làm cho phân tử trở thành một lưỡng cực (trừ trường hợp các liên kết phân cực tạo ra các moment lưỡng cực triệt tiêu nhau). Thí dụ
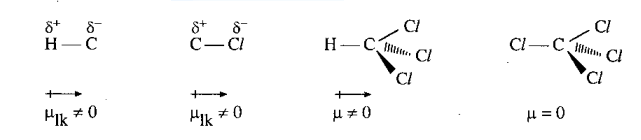
Các lưỡng cực luôn có xu hướng sắp xếp sao cho các cực trái dấu lại gần nhau. Vì thế tương tác giữa chúng gọi là tương tác định hướng. Lực tương tác lưỡng cực - lưỡng cực được tính theo công thức (1) với n = 4. Lực này tỉ lệ thuận với độ lớn của lưỡng cực p và p', vì vậy phân tử có các liên kết phân cực mạnh làm cho phân tử phân cực mạnh sẽ tương tác mạnh với nhau. Chẳng hạn, tương tác lưỡng cực - lưỡng cực ở dẫn xuất halogen lớn hơn, đồng thời khối lượng phân tử và độ phân cực hóa cũng lớn hơn ở hidrocacbon, làm cho nhiệt độ sôi, nhiệt độ nóng chảy cũng cao hơn. cis-dichloroethylene phân cực nên sôi ở nhiệt độ cao hơn trans-dichloroethylene.
b. Lực tương tác lưỡng cực - lưỡng cực cảm ứng
Dưới tác động của điện trường (Của ion hoặc của một lưỡng cực), một liên kết không phân cực hoặc một phân tử không phân cực sẽ trở thành phân cực tạm thời, tức là trong phân tử đã xuất hiện một lưỡng cực cảm ứng - nó đã bị phân cực hóa. Lưỡng cực cảm ứng này tương tác với lưỡng cực cố định bởi một lực phù hợp với công thức (1) n = 6. Tương tác này còn được gọi là tương tác cảm ứng.
c. Tương tác lưỡng cực cảm ứng - lưỡng cực cảm ứng
Đối với khí hiếm hoặc những chất mà phân tử không có liên kết nào phân cực như H2, O2, N2... và những phân tử không phân cực như CH4, CCl4.... thì liên kết Van der Waals giữa chúng được đảm bảo bởi tương tác lưỡng cực cảm ứng - lưỡng cực cảm ứng. Ta có thể hình dung như thế này, chẳng hạn trong trường hợp khí hiếm như sau: về tổng thể thì nguyên tử khí hiếm không phân cực nhưng vì các electron luôn luôn chuyển động nên ở một thời điểm nhất định bất kì, trọng tâm điện tích âm và điện tích dương không trùng nhau, do đó sinh ra một lưỡng cực nhất thời. Lưỡng cực này tác động tới các electron của các nguyên tử bên cạnh làm xuất hiện một lưỡng cực cảm ứng. Lưỡng cực cảm ứng này lại làm xuất hiện một lưỡng cực cảm ứng khác. Cứ như vậy, mọi nguyên tử nhất thời đều có thể trở thành một lưỡng cực cảm ứng, tuy không phải là hằng định và không có chiều cố định vì luôn thay đổi, nhưng chúng vẫn luôn tương tác với nhau. Lực tương tác giữa chúng tỉ lệ nghịch với r6 (công thức (1) với n = 6). Tương tác lưỡng cực cảm ứng - lưỡng cực cảm ứng còn gọi là tương tác khuếch tán, được nhà Vật lý học người Đức là Friz London nêu ra năm 1930 nên còn được gọi là lực London.
Lực khuếch tán tuy yếu nhưng có mặt ở bất kì iểu phân nào dù là ion, lưỡng cực hay không phân cực. Lực khuếch tán sinh ra từ tương tác của các lưỡng cực cảm ứng nên nó phụ thuộc vào độ phân cực hóa, đồng thời nó phụ thuộc vào số lượng electron trong phân tử. Số electron trong phân tử lại phụ thuộc vào số lượng nguyên tử trong phân tử, vì vậy phân tử càng lớn thì lực khuếch tán càng lớn. Chính khuếch tán đã đóng vai trò quyết định trong liên kết Van der Waals giữa các phân tử không phân cực, và giúp giải thích vì sao khi khối lượng phân tử tăng thì nhiệt độ nóng chảy, nhiệt độ sôi nói chung đều tăng.
Đối với các chất hữu cơ nguyên chất, tức là các phân tử đồng nhất thì bao giờ cngx có tương tác khuếch tán, còn tương tác định hướng và cảm ứng thì chỉ có khi trong phân tử có những liên kết phân cực làm cho phân tử trở thành phân cực.
